研究について
研究紹介 1
当教室では、難治性固形癌である肺癌や膵癌、胃癌などをとりあげ、難治化の要因である転移の分子機構解明とその分子標的治療開発や早期診断法開発に向けたトランスレーショナルリサーチを展開している。
当教室では、難治性固形癌である肺癌や膵癌、胃癌などをとりあげ、難治化の要因である転移の分子機構解明とその分子標的治療開発や早期診断法開発に向けたトランスレーショナルリサーチを展開している。
当教室では、難治性固形癌である肺癌や膵癌、胃癌などをとりあげ、難治化の要因である転移の分子機構解明とその分子標的治療開発や早期診断法開発に向けたトランスレーショナルリサーチを展開している。
非小細胞肺がんの分子標的薬耐性の機構解明とその克服
非小細胞肺がんの分子標的薬として、上皮成長因子受容体(EGFR)チロシンキナーゼ阻害剤(EGFR-TKI)であるゲフィチニブ(イレッサ)およびエルロチニブ(タルセバ)が認可されている。EGFR-TKIは、がん細胞がEGFR遺伝子変異を有する症例に奏効性が高い。しかし、奏効例もほぼ例外なく耐性を獲得し再燃すること(獲得耐性)や、EGFR遺伝子変異を有するにもかかわらず自然耐性を示す症例があることが問題となっている。
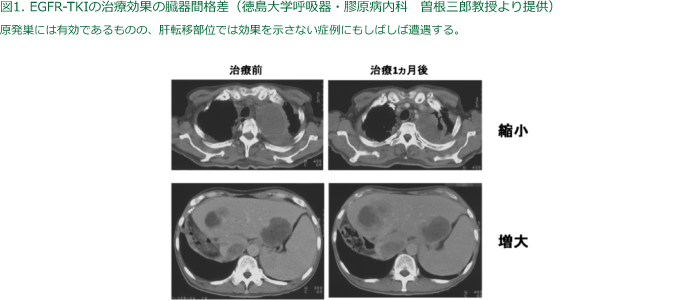
当教室は、肝細胞増殖因子(HGF)がEGFR-TKIの自然耐性および獲得耐性を誘導することを明らかにした(Yano S et al, Cancer Res 68, 9479, 2008)。日常臨床では、EGFR-TKI治療により原発巣には有効であるものの、肝臓や副腎などの転移巣では効果を示さない症例にしばしば遭遇する(図1)。また、EGFR-TKI獲得耐性後に治療を休止(drug holiday)し、一定の期間の後に再度TKI治療を開始(re-challenge)すると再び治療効果が得られる症例がある。このような臨床経験をふまえ、我々は、既報にあるgenomicな耐性機構(T790M変異、Met遺伝子増幅)では説明できないような、がん微小環境因子による臓器特異的な耐性化誘導機構が存在するのではないかという仮説を立て、肝細胞増殖因子HGFに着目するに至った。
 |
||
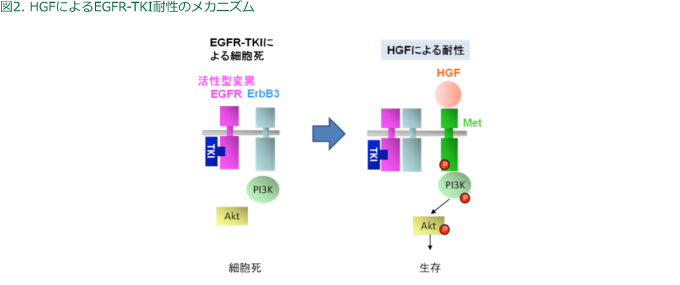
HGFは特異的受容体であるMETに結合しリン酸化することで、EGFRやErbB3とは無関係に下流のPI3K/Aktシグナルを活性化し、EGFR-TKIの耐性を誘導していた(図2)。
 |
||
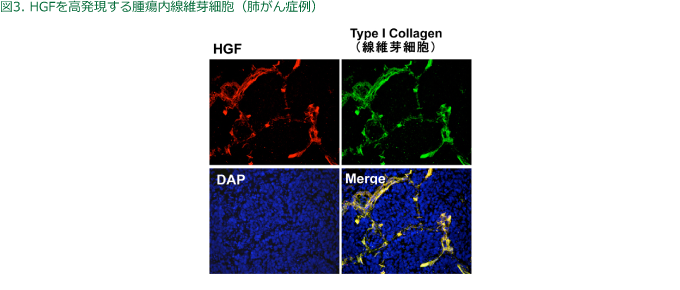
HGFはがん細胞のみならず宿主の線維芽細胞も産生する(図3)ことが知られている。
 |
||
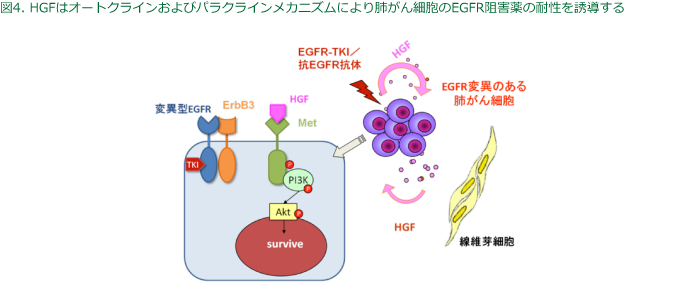
線維芽細胞のHGF産生能は症例により異なるが、線維芽細胞がHGFを高発現する場合には、肺がん細胞のEGFR-TKI耐性を誘導しうることも明らかにした(図4)。
(Wang W et al, Clin Cancer Res, 2009)
以上の研究成果より、HGFによるEGFR阻害薬耐性の克服のためにはHGF-MET阻害薬のほか、下流シグナル阻害薬と併用することが有効である可能性についても研究を進めてきている。
(Donev IS et al, Clin Cancer Res, 2010)
(Wang W et al, Clin Cancer Res, 2012)
(Koizumi H et al, JTO, 2012)
加えて、HGFによる薬剤耐性は、今後臨床での活躍が期待されている次世代EGFR-TKIや抗EGFR抗体の耐性化にも関与することや、その克服のためにはHGF/Metシグナルの制御が重要であることを明らかにしてきた(図4)。
(Yamada T et al, Clin Cancer Res, 2010)
(Yamada T et al, JTO, 2012)
(Wang W et al, Clin Cancer Res, 2009)
以上の研究成果より、HGFによるEGFR阻害薬耐性の克服のためにはHGF-MET阻害薬のほか、下流シグナル阻害薬と併用することが有効である可能性についても研究を進めてきている。
(Donev IS et al, Clin Cancer Res, 2010)
(Wang W et al, Clin Cancer Res, 2012)
(Koizumi H et al, JTO, 2012)
加えて、HGFによる薬剤耐性は、今後臨床での活躍が期待されている次世代EGFR-TKIや抗EGFR抗体の耐性化にも関与することや、その克服のためにはHGF/Metシグナルの制御が重要であることを明らかにしてきた(図4)。
(Yamada T et al, Clin Cancer Res, 2010)
(Yamada T et al, JTO, 2012)
 |
||
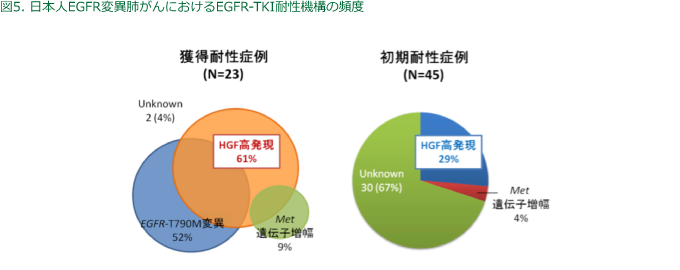
臨床検体を用いた検討は、前臨床試験の成果を臨床へ還元する上で大変重要なステップであり、我々は日本人のEGFR変異を有する肺がん検体を対象にHGF発現(免疫染色法)について検討した。EGFR-TKIに獲得耐性、自然耐性のうちHGF の高発現はそれぞれ、61%,29%で認め、臨床検体でもHGFが高頻度にEGFR-TKI の獲得耐性に関与していることが示唆されている(図5)。
(Yano S et al, JTO, 2011)
(Yano S et al, JTO, 2011)
 |
||
このように、当教室ではEGFR阻害薬をはじめとする分子標的薬耐性の克服を目指したトランスレーショナルリサーチを精力的に展開している。























